Луї де-Бройль і хвильова механіка
У 1923 р в роботі винятковою сміливістю і геніальною простотою французький фізик Луї де-Бройль писав: "В оптиці протягом століть занадто нехтували корпускулярним способом розгляду в порівнянні з хвильовим; Чи не робиться в теорії мікрочастинок зворотна помилка ". У цій роботі де-Бройль вказав шлях, завдяки якому можна
було пов'язати з частинками хвильові уявлення.
Його роботу продовжує і завершує чудовий німецький фізик
Ервін Шредінгер. А дещо пізніше, до 1926-1927рр., стає зрозумілим, що хвильова
механіка і квантова механіка - по суті справи рівнозачні терміни. Ця нова
механіка являє собою найважливіший розділ фізики, який вчить , як розглядати
поведінку мікрочастинок в тих випадках, коли ні корпускулярний аспект, ні
хвильовий недостатні для трактування подій.
Не слід занадто
буквально розуміти вираз, «електромагнітна хвиля». І радіовипромінювання, і
світло, і рентгенівські промені можуть бути розглянуті в двох аспектах;
хвильовому і корпускулярному. Абсолютно таке ж твердження справедливе і для
потоків частинок. Хоча потоки частинок мають чіткі відмінності від
електромагнітного випромінювання (головне з них те, що електрони, ядра,
нейтрони і іони можуть рухатися з будь-якими швидкостями, а фотони - тільки зі
швидкістю 300000 км / с), цей вид матерії також виявляє в різних експериментах
то властивості хвилі, то властивості корпускул.
Яка ж довжина хвилі, яку треба приписати рухомій
частинці? За допомогою міркувань, які в дещо спрощеному вигляді ми зараз
викладемо, де-Бройль показує. (Вірніше сказати, здогадується), чому повинна
бути рівна довжина хвилі, пов'язана з потоком частинок.
Звернемося до основних співвідношень, які пов'язують
корпускулярний аспект електромагнітного випромінювання з хвильовим. Порція
енергії електромагнітного випромінювання, яку несе з собою фотон, виражається
формулою Е = hν. Енергія фотона, як і будь-яка інша порції матерії,
підпорядковується рівнянням Ейнштейна. Таким чином, енергія фотона може бути
представлена і формулою Е = mc2. Звідси випливає, що маса фотона m =
hν / с2 Перемноживши масу на швидкість, ми отримаємо значення
імпульсу фотона p = h / λ.
Але нас цікавить довжина хвилі частинки, маса спокою якої
відмінна від нуля. Як здогадатися, чому вона дорівнює? Допустити, що все
наведене міркування залишається в силі; прийняти, що співвідношення між
імпульсом і довжиною хвилі є універсальним! Залишається переписати цей вираз у
вигляді:
λ = h / mv.
Це і є знаменита формула де-Бройля. Вона показує, що
хвильовий аспект потоку частинок повинен проявлятися особливо чітко, коли
невеликі маса і швидкість частинки. Це і підтверджується дослідом, бо дифракцию
частинок виявляється легко спостерігатиу випадку електронів і повільних
нейтронів.
Перевірка справедливості тільки що наведеного міркування,
яке, до речі кажучи, свого часу сприймалося як гра поняттями, цілком
прямолінійна. Треба зняти з однієї і тієї ж речовини рентгенограму,
електронограму і нейтронограму. Підігнавши швидкості частинок таким чином, щоб
довжини хвиль були однакові у всіх випадках, ми повинні отримати тотожні (по
відношенню до радіусів кілець) дебаєграми. Так воно і виявилось.
У 1927 р випадково здійснилася перша перевірка формули
де-Бройля. Англійські фізики Девіссон і Джермер проводили досліди з розсіювання
електронів па поверхні металів і при роботі з приладом їм трапилося перегріти
об'єкт. Об'єкт був полікристалічним, а після нагрівання перекристалізувався,
тепер промені розсіювалися монокристалом.Утворена картина була настільки схожа
на відповідні рентгенограми, що не було ніякого сумніву в тому, що електрони
мають здатність дифрагувати, як і рентгенівські промені. Досить скоро спостереження електронної дифракції перетворилося в метод
дослідження будови речовин, який у багатьох випадках виявлявся більш придатним,
ніж рентгеноструктурний аналіз. Основна область застосування електронографії -
це вивчення структури тонких плівок. Принципи нічим не відрізняються від тих,
які ми обговорювали раніше. Різниця полягає в тому, що електронні промені
розсіюються електронами і ядрами, в той час як рентгенівські промені
розсіюються тільки електронами.
Так як довжина хвилі частинки обернено пропорційна масі,
то зрозуміло, що дифракцию молекул спостерігати важко.Дифракцію протонів
спостерігати можна, але вона не представляє будь-якого інтересу: для
дослідження об'ємної структури протони не годяться через малу проникy
здатність, а для вивчення поверхні краще застосовувати дифракцію електронів -
вона дає незрівнянно більш багату інформацію про структуру.
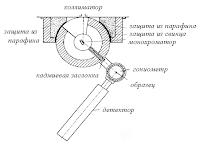
Ліпше працювати з нейтронами. Дослідження дифракції цих
частинок стало предметом заняття багатьох сотень учених. Ця галузь науки
отримала назву нейтронографії. Отримати нейтронограму технічно багато важче,
ніж рентгенограму. Перш за все, досить сильний пучок нейтронів відповідної
довжини хвилі (а довжина хвилі регулюється швидкістю нейтронів) можна створити
лише виведенням цих частинок через спеціальний канал в атомному реакторі. Друга
складність полягає в тому, що розсіювання нейтронів невелика; вони ж легко
проходять через речовину, не стикаючись з ядрами його атомів. Тому потрібно
працювати з великими кристалами, розміром близько сантиметра. А такі кристали
не так легко отримати. І, нарешті, третя обставина: нейтрони не залишають сліду
на фотопластинці, а в іонізаційних приладах дають про себе знати лише побічно.
Так чому все-таки дослідники займаються нейтронографією?
Справа полягає в тому, що нейтрони, на відміну від рентгенівських променів, не
розсіюються електронами а відхиляються від свого шляху при зустрічах з атомними
ядрами. Можна привести багато прикладів речовин, атоми яких по числу електронів
відрізняються незначно, а за властивостями ядер - різко. У подібних випадках
рентгенівські промені не розрізнять атомів, а нейтронографія призведе до
успіху. А мабуть найголовніша обставина - це те, що нейтрони сильно розсіюються
ядрами атомів водню, в той час як рентгенівські промені здатні встановити
розташування атомів водню лише наближено: адже у атома водню всього лише один
електрон. А знати розташування цього атома дуже важливо. У величезному числі
органічних і біологічних систем атом водню пов'язує між собою частини однієї
молекули або сусідні молекули. Цей особливий зв'язок так і називається
«водневий». Також поза конкуренцією перебуває можливість нейтронографії
відрізняти атомні ядра, що володіють різними магнітними властивостями. Цих
причин досить, для того, щоб зробити нейтронографіїю важливим методом
дослідження речовини.